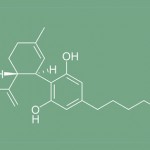
CBD : des études révèlent ses effets antipsychotiques

Réalisé aux Pays-Bas, un examen des recherches existant sur le cannabidiol (CBD) souligne son efficacité en tant qu’antipsychotique. Il s’avérerait d’ailleurs plus efficace dans la réduction des épisodes psychotiques que les produits pharmaceutiques prescrits actuellement avec moins d’effets secondaires.
La schizophrénie concernerait environ 600 000 personnes en France. Elle apparaît le plus souvent pendant l’adolescence, entre 15 et 25 ans, et touche aussi bien les hommes que les femmes, mais apparaîtrait de manière plus précoce chez les hommes. Les symptômes sont très variables, entre paranoïa ou mégalomanie et une émotivité en berne. Le cannabis est souvent pointé du doigt dans la survenue de la schizophrénie.
Effets antipsychotiques du CBD
Les études passées en revue par la psychologue judiciaire Lilian Kloft et publiées dans le Maastricht Student Journal of Psychology and Neuroscience mettent en avant de manière pragmatique les effets antipsychotiques du CBD.
Lilian Kloft a compilé des recherches « expérimentales » et « non-cliniques » qui étudiaient l’efficacité du CBD sur la schizophrénie. Ces études étaient basées sur « des modèles animaux de psychose, des études expérimentales sur les humains, des études de neuroimagerie, des études épidémiologiques et des études cliniques ».
Après avoir noté que le CBD justifiait des « essais cliniques aléatoires, à grande échelle et sur le long-term », Kloft conclut sur les études comparées : « Les études pré-cliniques et cliniques […] apportent un soutien initial prometteur pour le CBD comme composé antipsychotique efficace et sûr. Des preuves préliminaires indiquent une forte tolérance, un rapport qualité-prix supérieur, et un profil d’effets secondaires prometteur, suggérant une alternative attractive aux traitements antipsychotiques actuels ».
-
Cannabis en France4 semaines ago
Le français Tom Félix risque la peine de mort pour cannabis en Malaisie
-
Cannabis en France4 semaines ago
La guerre cachée contre le cannabis : la France est-elle manipulée pour alimenter la prohibition ?
-
Cannabis aux Pays-Bas4 semaines ago
De YouTube à Amsterdam : Drewissharing ouvre son coffeeshop
-
Cannabis en République Tchèque1 semaine ago
Le Sénat tchèque vote la légalisation du cannabis
-
Cannabis dans l'espace1 semaine ago
Un vaisseau SpaceX transportant des graines de cannabis s’écrase dans l’océan
-
Business4 semaines ago
Josh Kesselman (RAW) rachète High Times pour 3,5 millions $
-
Business3 semaines ago
France : un rapport inédit dresse l’état des lieux du cannabis médical
-
Cannabis en Thaïlande2 semaines ago
La Thaïlande annonce limiter l’usage de cannabis aux seules fins médicales





































You must be logged in to post a comment Login